Innowacyjna platforma technologiczna inPROBE® ma potencjał do zastosowania w wielu różnych obszarach diagnostycznych. Wykorzystuje zupełnie nowe podejście do oznaczania ekspresji białek. Metoda ta umożliwia przeprowadzenie diagnostyki in vivo, czyli bezpośrednio w ciele pacjentki bez pobierania próbek tkanki. Obiektywny numeryczny wynik dostępny jest niemal natychmiast, bo już po około 30 minutach. Spółka po podsumowaniu I części badań klinicznych kieruje wzrok ku kolejnym obszarom zastosowań przełomowej technologii.
Nieodłączną cechą nowoczesnej onkologii jest personalizacja, przejawiająca się w przejściu ze strategii stosowania jednakowych schematów chemioterapii u wszystkich chorych z określonym typem nowotworu (fit-to-all) do terapii dostosowanej do indywidualnej sytuacji pacjenta.
Ważnym elementem personalizacji jest rozwój terapii ukierunkowanych molekularnie, tzw. terapii celowanych, działających na określone cele molekularne związane z komórką nowotworową, będące najczęściej białkami wykazującymi ekspresję na powierzchni komórki.
Jednym z najwcześniej poznanych jest receptor ludzkiego naskórkowego czynnika wzrostu 2 (human epidermal growth factor receptor 2 – HER2), białko z rodziny receptorów naskórkowych czynników wzrostu (EGFR). Nadekspresję białka HER2 stwierdzono na komórkach raka piersi, ale także raka żołądka czy też niektórych rzadkich podtypów raka płuca [1].
W przypadku raka piersi nadekspresja HER2 jest związana z agresywniejszym rozrostem nowotworu i gorszym rokowaniem (niekorzystny czynnik prognostyczny), jednocześnie umożliwiając zastosowanie ukierunkowanej terapii przy użyciu przeciwciała monoklonalnego skierowanego przeciwko temu białku (korzystny czynnik predykcyjny).
Obecnie ekspresję HER2 na komórkach raka piersi określa się przy użyciu metody immunohistochemicznej (IHC) oraz – w wątpliwych przypadkach – hybrydyzacji in situ (FISH) z wykorzystaniem tkanki nowotworu, pobranej w drodze biopsji lub operacyjnie. W metodzie IHC wykorzystuje się barwnik chemiczny i ocenia wynik reakcji w zakresie 0-3+. W przypadku 0-1 ekspresję HER2 uznaje się za ujemną, wynik 2+ wymaga potwierdzenia przy użyciu FISH (dodatni wynik FISH kwalifikuje nowotwór jako HER2 dodatni), a wartość 3+ oznacza dodatnią ekspresję HER2.
W ostatnim czasie wprowadzono pojęcie HER2-low, określające niską ekspresję białka HER2, niewykrywalną standardowymi metodami, ale jednak będącą nadal pozytywnym czynnikiem predykcyjnym, a więc wskazaniem do zastosowania odpowiedniego leczenia ukierunkowanego na to białko. Zmianę klasyfikacji ekspresji białka HER2 przedstawia poniższa rycina [2].
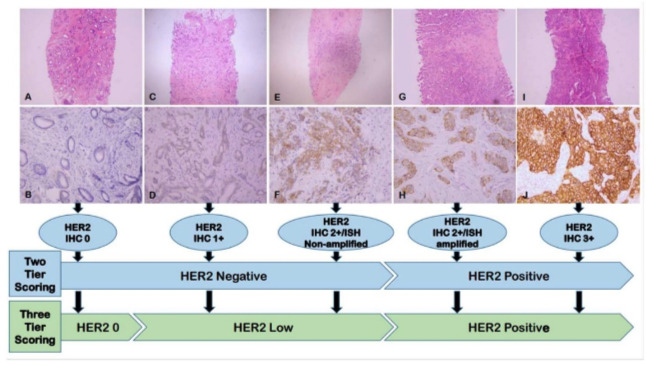 Fig. 1 Aktualny paradygmat oceny nadekspresji HER2 [2]
Fig. 1 Aktualny paradygmat oceny nadekspresji HER2 [2]
Podjęta ostatnio (5 kwietnia 2024 r.) przez amerykańską Agencję ds. Żywności i Leków (Food and Drug Administration, FDA) decyzja o rejestracji w przyspieszonym trybie produktu leczniczego fam-trastuzumab deruxtecan-nxki (Enhertu, Daiichi Sankyo, Inc.) „dla dorosłych pacjentów z nieresekcyjnymi lub przerzutowymi guzami litymi HER2-dodatnimi (IHC3+), którzy wcześniej otrzymali leczenie ogólnoustrojowe i nie mają zadowalających alternatywnych opcji terapeutycznych” jeszcze bardziej podkreśla potrzebę korzystania z wiarygodnych metod oznaczania ekspresji HER2 [3].
Należy też podkreślić, że niezależnie od zmiany poglądów dotyczących ekspresji białka HER2 na komórkach nowotworowych, uzyskany wynik ma charakter subiektywny, co w oczywisty sposób wiąże się z ryzykiem uzyskania nieprecyzyjnych wyników, a to z kolei może prowadzić do niedostatecznego/nieoptymalnego leczenia pacjentek z wynikiem fałszywie ujemnym, lub niepotrzebnego, nadmiernego leczenia w przypadku wyniku fałszywie dodatniego.
Firma SDS Optic SA z Lublina opracowała platformę technologiczną inPROBE® przeznaczoną właśnie do oznaczania ekspresji białek w sposób odmienny od standardowego. Po pierwsze, oznaczenie przeprowadza się in vivo, tzn. bezpośrednio w organizmie pacjentki, bez konieczności pobierania tkanki, po drugie, oznaczenie możliwe jest zarówno w samym guzie, jak i w jego bezpośrednim otoczeniu, po trzecie, wynik uzyskuje się w czasie rzeczywistym, tj. po około 30 minutach i wreszcie po czwarte, wynik ma charakter ilościowy, a więc jest wynikiem obiektywnym, wyrażonym w liczbach.

Platforma technologiczna opracowana przez SDS Optic opiera się na połączeniu technologii światłowodowej wykorzystującej czujniki funkcjonalizowane białkami rozpoznającymi określony marker diagnostyczny, np. białko HER2. Wywołany oddziaływaniem białka z powierzchnią czujnika sygnał optyczny po przeliczeniu przy użyciu algorytmu matematycznego przekłada się na liczbową wartość poziomu ekspresji białka.
Pierwszym białkiem, dla którego opracowano odpowiednią sondę inPROBE® było właśnie HER2. W celu potwierdzenia możliwości zastosowania inPROBE® w praktyce klinicznej oraz określenia bezpieczeństwa tej nowej technologii przeprowadzono „Otwarte, wieloośrodkowe, jednoramienne badanie kliniczne bezpieczeństwa i skuteczności mikrosondy diagnostycznej (inPROBE®) przeznaczonej do oceny ekspresji receptora HER2 w populacji kobiet z wysokim ryzykiem raka piersi” (SDS-HER-01-2018), którego I część została niedawno zakończona.
Do badania włączono 22 pacjentki, a do analizy statystycznej ostatecznie 18 pełnoletnich pacjentek z rozpoznanym rakiem piersi i znanym statusem ekspresji HER2, oznaczonym przy użyciu standardowych metod, tj. immunohistochemii (IHC) i fluorescencyjnej hybrydyzacji in situ (FISH). W badanej grupie było 6 pacjentek z HER2-dodatnim i 12 pacjentek z HER2-ujemnych rakiem piersi zgodnie z wynikami IHC/FISH.
Pierwszorzędowym punktem końcowym badania było wstępne określenie zakresu stężeń receptora HER2 mierzonych za pomocą mikrosondy inPROBE® odpowiadających statusowi receptora HER2 określonego standardową metodą diagnostyczną (badania IHC i FISH).
Porównano zakresy stężeń receptora HER2 oznaczonych przy użyciu mikrosondy inPROBE® (dla których obliczono medianę, średnią oraz wartości minimalne i maksymalne) ze statusem HER2-dodatnim i HER2-ujemnym oznaczonym standardowymi metodami. Wykazano wyraźną tendencję liczbową w kierunku wyższych wartości w grupie HER2-dodatniej w porównaniu z grupą HER2-ujemną mimo niewielkiej liczebności całej badanej populacji (co jest typowe dla badań wczesnych faz) i większej liczby pacjentek z nowotworem HER2-ujemnym. Dla wartości minimalnych zakresów stężeń oznaczonych przy użyciu sondy inPROBE® uzyskano istotność statystyczną (test sumy rang Wilcoxona; p=0,041). Obserwacje te potwierdzono w analizie przeprowadzonej z wykorzystaniem liniowych modeli mieszanych dla powtarzanych pomiarów.
Analizując uzyskane wyniki zwrócono uwagę na wpływ liczebności całej grupy i poszczególnych podgrup, niemniej jednak obecny stan wiedzy wskazuje, że grupa pacjentek HER2-ujemnych stanowiła prawdopodobnie niejednorodną populację, w której były także pacjentki z cechą HER2-low. Można zatem założyć, że opracowana technologia inPROBE® umożliwiła wykrycie pewnej cechy biologicznej raka piersi, co potwierdzono następnie w dużych, międzynarodowych badaniach [2, 4]. Z tego względu w II części badania zostaną wprowadzone odpowiednie modyfikacje do protokołu, umożliwiające precyzyjniejszą ocenę barwienia IHC i dostosowanie oznaczeń ekspresji HER2 przy użyciu sondy inPROBE® do aktualnej klasyfikacji ekspresji HER2.
Drugorzędowym punktem końcowym badania było porównanie korelacji stężeń receptorów HER2 wykrytych jedną mikrosondą inPROBE® zlokalizowaną w guzie i drugą mikrosondą w bezpośredniej okolicy guza u pacjentek HER2-dodatnich. Choć nie uzyskano tego punktu końcowego, prawdopodobnie w związku z niewielką liczba pacjentek z nowotworem HER2 dodatnim (n=6), niemniej jednak wykazano istotną statystycznie korelację stężeń receptorów HER2 wykrytych przy użyciu mikrosondy inPROBE® w guzie oraz w bezpośredniej okolicy guza dla całej badanej populacji (pacjentki HER2-dodatnie i HER2-ujemne) (p=0,046).
W części I badania klinicznego oceniano także bezpieczeństwo procedury. Podczas badania diagnostycznego nie stwierdzono występowania żadnych wad, uszkodzeń, awarii i pęknięć mikrosondy inPROBE®. Nie wykazano także żadnych zdarzeń dotyczących bezpieczeństwa związanego z samym urządzeniem ani żadnych działań niepożądanych u pacjentek uczestniczących w badaniu.
Wyniki I części badania klinicznego dotyczącego pomiaru ekspresji białka HER2 w raku piersi uzasadniają rozpoczęcie kolejnych projektów badawczych. Będą one obejmowały inne nowotwory wykazujące ekspresję HER2, ocenę poziomu białek związanych z zakażeniami wirusowymi, a także badanie innych rodzajów materiału biologicznego, takich jak pobrane tkanki czy płyny ustrojowe.
Zebrane dotychczas dane wskazują, że platforma technologiczna inPROBE® jest multipotencjalną, skuteczną i bezpieczną metodą ilościowego oznaczania różnych białek w materiale biologicznym.
Wydaje się też, że może ona znaleźć szersze zastosowanie nie tylko w medycynie, gdzie może być wykorzystywana też do opracowywania leków i określania ich farmakokinetyki, ale także w innych obszarach nauki korzystających z postępu biologii molekularnej i genetyki, takich jak rolnictwo, weterynaria, kryminalistyka czy przemysł spożywczy i chemiczny.
Piśmiennictwo
1. Iqbal Ni, Iqbal Na. Human Epidermal Growth Factor Receptor 2 (HER2) in Cancers: Overexpression and Therapeutic Implications. Mol Biol Int 2014; 2014: 852748.
2. Zhang H, Peng Y. Current Biological, Pathological and Clinical Landscape of HER2-Low Breast Cancer. Cancers 2023, 15, 126.
3. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-fam-trastuzumab-deruxtecan-nxki-unresectable-or-metastatic-her2 [Dotęp: 07.04.2024]
4. Tarantino P, Hamilton E, Tolaney SM, et al. HER2-Low Breast Cancer: Pathological and Clinical Landscape. J Clin Oncol 2020; 38(17): 1951.
